Achegándonos ao LHC
O uso das tecnoloxías presentes nos aceleradores de partículas, e, en particular, os avances na xeración de campos magnéticos, é a base da Hadronterapia (ou protonterapia, se nos referimos específicamente ao uso de protóns) como técnica médica.
O emprego departículas pesadas cargadas (protones e iones pesados - hadróns en xeral) en radioterapia permite unha distribución de dose nos tecidos completamente diferente á radioterapia convencional (ver figura), o que constitúe a súa principal avantaxe fronte á radioterapia con fotóns (R-X). Cando estas partículas penetran no organismo, a súa perda de enerxía por unidade de longixude é inversamente proporcional ao cadrado da súa velocidade. Esta dependencia fai que a máxima perda de enerxía e maior densidade de ionización se produza ao final do perecorrido da partícula (Pico de BRAGG), cando a súa velocidade é próxima a cero.
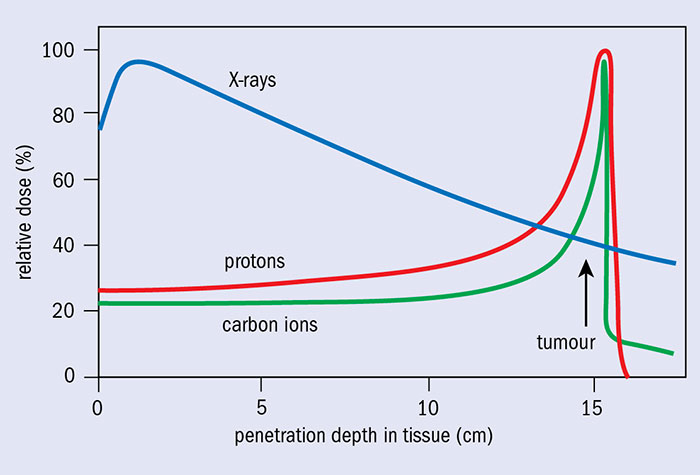
Pico de Bragg. (Imaxe: CERN Courier)
A tasa de perda de enerxía dun feixe monoenerxético ao atravesar un medio uniforme é sempre a mesma, polo que as partículas do feixe se frearán á mesma profundidade, o que se denomina rango da partícula. Polo tanto, a profundidad do pico de Bragg depende da enerxía inicial desas partículas e dos tecidos que atravesan. Modulando a enerxía das partículas incidentes, é posible extender a rexión do pico de Bragg para focalizar a dosis nun volume máis extenso. É dicir, para asegurar unha dose uniforme en todo o volume do tumor superpóñense varios picos de Bragg de diferente enerxía (lánzanse protóns que depositarán a súa enerxía a distintas profundidades do tumor.). Isto é o que se chama Spread Out Bragg Peak (SOBP), que podería traducirse como “ensanche do pico de Bragg” ou "pico de Bragg extendido".
Ademais, a dose de radiación disminúe bruscamente detrás do pico de Bragg, o que evita que órganos críticos e tecido sano reciban radiación non desexada.
Estas características físicas dos feixes de protones e ions fan que este tipo de radioterapia esté especialmente indicada para tumores profundos ou tumores próximos a estructuras críticas do organismo, xa que a dose proporcionada ao tecido san colindante ao tumor se reduce considerablemente respecto á proporcionada pola radioterapia convencional.
En relación ás técnicas de tratamento, existen dous principais: sistema de dispersión pasiva (‘single/double-scattering’) e sistema de dispersión activa (‘beam-scanning’). Os sistemas de dispersión pasiva utilizan materiais que permiten dispersar o feixe de protóns (hadrón) na súa dirección transversal ata conseguir unha dose uniforme en todo o ancho do tumor. Porén, nos sistemas activos, aproveitando o feito de que son partículas cargadas, utilízase un sistema de deflexión magnético para mover o feixe vertical e horizontalmente ata cubrir toda a superficie do tumor. Foi en 1997 cando se comezou a desenvolver o sistema activo no GSI (Helmholtzzentrum für Schwerionenforschung, Alemania) e no PSI (Paul Scherrer Institute, Villingen, Suiza), Desde aquela, e tomando todas as innovacións, melloras e optimizacións no campo dos aceleradores de partículas, e, en particular, na área dos campos magnéticos, téñense logrado grandes avances na Protonterapia (Hadronterapia).
Inicialmente, usábanse sistemas de dispersión pasiva para dirixir e focalizar os hadróns, pero en 1997 comezouse a desenvolver, no GSI (Helmholtzzentrum für Schwerionenforschung, Alemania) e no PSI (Paul Scherrer Institute, Villingen, Suiza), o chamado “sistema de dispersión activa” no que os hadróns cargados son guiados magnéticamente sobre a zona de tratamento. Desde entón, e tomando todas as innovaciones, melloras e optimizacións no campo dos aceleradores de partículas, e, en particular, nol uso dos campos magnéticos, téñense logrado grandes avances na Hadronterapia.
Para lograr unha mayor flexibilidad no tratamento, o acelerador acóplase a un sistema de distribución do feixe chamado ‘gantry’ que permite focalizar os hadróns sobre o tumor desde calquera ángulo.
Equipo Gantry. (Imaxe: CERN Courier)
Un esquema dun área de protonterapia (hadronterapia) pode presentarse así:
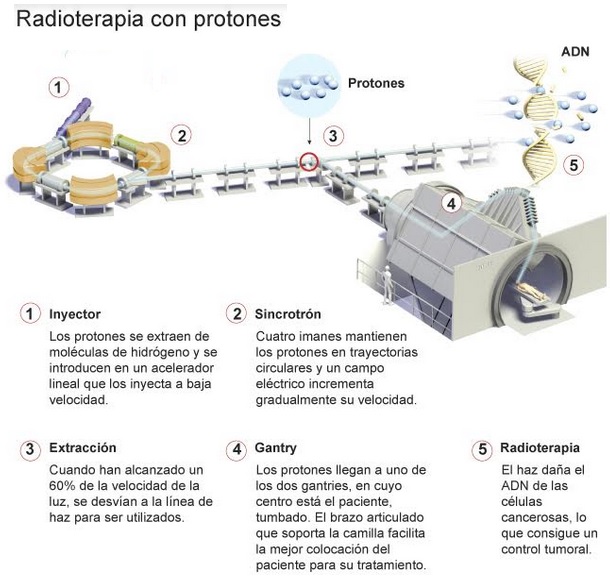
(Imaxe desde unha infografía do diario El Mundo)
Unha aportación novidosa do CERN é GaToroid, un toroide superconductor e lixeiro que pode rodear a un doente e mellorar significativamente o suministro de hadróns .
En España están en fase de desenvolvemento 10 centros de Hadronterapia para o sistema público. En particular, o Centro de Protonterapia de Galicia será un referente europeo. Agárdase que estea en funcionamento en 2025. Ademais de contar cunha área para o tratamento de pacientes, contará cunha zona destinada exclusivamente á investigación.
Máis información:
https://enlight.web.cern.ch/what-is-hadron-therapy
https://cerncourier.com/a/cern-takes-next-step-for-hadron-therapy/
https://cerncourier.com/a/proton-therapy-enters-precision-phase/
https://home.cern/news/news/knowledge-sharing/clinical-trials-using-carbon-ions-begin-cnao-0
|
AUTORES Xabier Cid Vidal, Doctor en Física de Partículas (experimental) pola Universidad de Santiago (USC). Research Fellow in experimental Particle Physics no CERN, desde xaneiro de 2013 a decembroe de 2015. Estivo vencellado ao Depto de Física de Partículas da USC como becario "Juan de la Cierva", "Ramon y Cajal" (Spanish Postdoctoral Senior Grants), e Profesor Contratado Doutor. Desde 2023 é Profesor Titular de Universidade nese Departamento (ORCID). Ramon Cid Manzano, foi catedrático de Fïsica e Química no IES de SAR (Santiago - España), e Profesor Asociado no Departamento de Didáctica de Ciencias Experimentais da Facultade de Educación da Universidad de Santiago (España), ata o seu retiro en 2020. É licenciado en Física, licenciado en Química, e Doutor pola Universidad de Santiago (USC).(ORCID). |
CERN CERN Experimental Physics Department CERN and the Environment |
LHC |
NOTA IMPORTANTE
Toda a Bibliografía que foi consultada para esta Sección está indicada na Sección de Referencias
© Xabier Cid Vidal & Ramon Cid - rcid@lhc-closer.es | SANTIAGO |



